Страница: 2/5
удобно выявлять иммунный комплекс, используя способность фермента расщеплять субстрат, который при ферментативной модификации изменяет свой цвет. В этом случае для выявления комплекса антиген - антитело обычно используют спектрофотометрию;
- ммунный комплекс можно выявлять с помощью иммуноферментного анализа как в растворе, так и при адсорбции (или ковалентной иммобилизации) на твердом носителе. Различают два принципиально различных типа ИФА - гомогенный и гетерогенный (твердофазный) иммуноферментный анализ.
Гомогенный иммуноферментный анализ (ГИФА) - наиболее простой в методическом отношении вид ИФА. При его постановке один из участников иммунной реакции (обычно это низкомолекулярный антиген) метится ферментом и за ходом формирования комплекса антиген-антитело следят, регистрируя изменение активности фермента.
Такое нарушение ферментативной активности может возникать либо за счет пространственного разобщения фермента и субстрата, либо за счет конформационных изменений в молекуле фермента, сопровождающих формирование иммунного комплекса. ГИФА имеет ряд существенных преимуществ перед другими иммунохимическими методами. Во-первых, высокая экспрессия (весь анализ с помощью ГИФА , занимает минуты и даже доли минут).
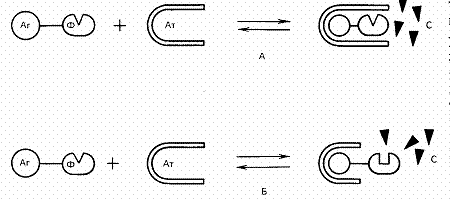
Рис. Варианты гомогенного иммуноферментного анализа (А- эффект разобщения фермента (Ф) и субстрата (С) за счет стерических препятствий при взаимодействии антигена (Аг) и антитела (Ат); Б- эффект изменения конформации фермента при формировании комплекса антиген- антитело.
Во-вторых, метод имеет одну стадию и не требует трудоемких и требующих времени этапов промывки. И наконец, в-третьих, метод требует минимальных объемов (8-50 мкл) и количеств биологического или клинического образца. Однако у метода ГИФА имеется один крайне существенный недостаток - на его основе можно создавать диагностические тест-системы только для низкомолекулярных антигенов. Только, в этом случае антитело, взаимодействуя с антигеном, может эффективно экранировать или модифицировать связанную с этим антигеном молекулу фермента. Именно в связи с этим, ( несмотря на кажущуюся простоту и очевидные преимущества перед другими методами, на основе ГИФА были созданы диагностикумы для выявления только гормонов, пептидов, лекарственных и наркотических веществ и некоторых низкомолекулярных белков.
Гетерогенный (твердофазный) иммуноферментный анализ (ТФИФА или ЕLISА) в последние годы особенно широко используется в биологии и медицине. Как и для других твердофазных методов анализа, характерной особенностью ТФИФА является то, что в процессе проведения анализа один из участников реакции антиген - антитело иммобилизуется на твердом носителе. Эту фиксацию антигена или антител можно осуществлять либо путем их ковалентной «пришивки» к полимерной или стеклянной матрице, либо путем их физической адсорбции на твердом носителе за счет достаточно прочных сил электростатического и ван-дер-ваальсового взаимодействия. Идея иммобилизации иммунного комплекса важна для анализа многокомпонентных смесей макромолекул, когда в системе должны оставаться только те компоненты смеси, которые обладают нужными иммунохимическими свойствами. Именно твердофазные методики позволяют избавиться от балластных, не вошедших в иммунный комплекс антигенов простой промывкой.
Необходимо отметить, что в своей физико-химической основе твердофазный ИФА очень сходен с твердофазным РИА. Отличие касается лишь индикаторных молекул - в ТФИФА это фермент, в твердофазном РИА это радиоактивные изотопы. Остальные же принципы анализа полностью совпадают - в обоих методах используется твердая матрица, на которой адсорбируется иммунный комплекс, и идентичный способ удаления из системы не вошедших в комплекс компонентов диагностикума.
В настоящее время уже опубликованы обзоры, подробно анализирующие схемы проведения диагностических исследований с использованием метода твердофазного ИФА.
Для обнаружения в биологических и клинических образцах бактериальных и вирусных антигенов особенно часто применяется так называемый сэндвич-метод или модифицированный сэндвич-метод. При использовании этих методик на твердую подложку (обычно полистирол) сорбируются последовательно первичные антитела, выявляемый антиген и вторичные антитела. В случае двойного сэндвич-метода ферментная метка вводится в состав вторичных антител, в случае модифицированного двойного сэндвич-метода вторичные антитела (немеченые) «проявляются» антивидовыми меченными ферментом иммуноглобулинами. Особая популярность последней разновидности ТФИФА объясняется тем, что для выполнения методики нет необходимости синтезировать специфические для каждого конкретного антигена конъюгаты (меченные ферментом антитела).
В последние годы были разработаны методики ТФИФА, использующие в качестве «проявляющих» конъюгатов молекулярные комплексы ферментов с белком А золотистого стафилококка. Как известно, это белок взаимодействует с высокой константой связывания с тяжелой цепью (Fс-фрагментами) иммуноглобулинов. Это позволяет построить диагностические системы, где - в качестве «проявляющего» агента используются не антивидовые антитела, а белок А. В этом случае, однако, возникают некоторые трудности, связанные с неспецифичностью белка А, который взаимодействует с Fс-фрагментами любых антител. Если использовать обычную сэндвич-методику, заменив лишь антивидовой конъюгат на конъюгат на основе белка А, последний будет взаимодействовать не только со вторичными антителами, но и с первичными иммуноглобулинами, давая положительную реакцию, даже если проба не содержит искомого антигена. В этом случае имеется несколько вариантов решения проблемы. Во-первых, в качестве первичных антител в методике можно использовать иммуноглобулины, с которыми белок А взаимодействует слабо (например, с мышиными иммуноглобулинами). Во-вторых, возможна прямая адсорбция антигена на полистирол, когда первичные антитела просто не используются. И, наконец, в качестве первичных антител можно применять не полные молекулы иммуноглобулинов, а молекулы, лишенные Fс-фрагментов, - так называемые Раb2 -фрагменты. В этом последнем случае дополнительным удобством методики будет являться то, что для конструирования диагностической системы можно будет использовать не две сыворотки, полученные от разных животных, а одну. Именно в связи с этими обстоятельствами в настоящее время разработано и разрабатывается большое число диагностических методик, использующих конъюгаты на основе белка А.
Построение диагностикумов для серодиагностики бактериальных и вирусных заболеваний, выявление и идентификация с их помощью антител в биологических и клинических образцах проводится аналогичным образом. Обычно приготовляется так называемый иммуносорбент - антиген, иммобилизованный на твердом носителе (либо за счет его прямой сорбции на твердую матрицу, либо за счет ковалентной «пришивки» к этой матрице, либо за счет иммуносорбции на иммобилизованные первичные антитела). Затем исследуемая сыворотка, содержащая или не содержащая выявляемые антитела, контактирует с иммуносорбентом. Степень адсорбции специфических к иммобилизованному антигену иммуноглобулинов обычно определяется с помощью антивидовых конъюгатов. Использование антивидовых антител к различным классам иммуноглобулинов позволяет выявить в исследуемом образце не только специфические к использованному антигену антитела, но и провести их изотиповой анализ.
Конкретные методики диагностики и серодиагностики заболеваний бактериальной и вирусной природы, использующие иммуноферментные подходы, отличаются многими параметрами, в частности, типом и формой адсорбента, на котором иммобилизуется иммунный комплекс. В качестве твердофазного носителя может использоваться целый ряд полимеров: полиметилметакрилат., и нейлон, тефлон, полипропилен и др. Однако наиболее часто в качестве адсорбента в настоящее время применяется полистирол и поливинилхлорид. Для удобства проведения анализа эти адсорбенты производятся в виде многолуночных плашек, шариков или палочек. Использование плашек, изготовленных из оптически прозрачного полистирола или поливинилхлорида позволяет проводить все операции ТФИФА, включая конечное фотометрирование хромофорной субстратной смеси. Не менее существенным преимуществом полистироловых плашек перед другими формами адсорбента является возможность автоматизации практически всех операций анализа, включая трудоемкие этапы промывки лунок и внесения в них однотипных реагентов.
Следует отметить, что использование полистироловых плашек для целей ТФИФА имеет и некоторые недостатки - высокие требования к чистоте полимерного материала и точности изготовления плашек и нерентабельность их использования для одиночных анализов.
Большое внимание при постановке ТФИФА обычно уделяется правильному выбору фермент-субстратной системы. В современных диагностических иммуноферментных тест-системах используется большое число разнообразных ферментов и субстратов. Выбор той или иной фермент-субстратной пары для использования в конкретной тест-системе на основе ТФИФА диктуется несколькими соображениями. Во-первых, обращается внимание на стабильность в процессе анализа и хранения как крайне чувствительного к структурным внутримолекулярным перестройкам конъюгата, так и во многих случаях светочувствительного хромофорного или флуорохромного субстрата. Во-вторых, это отсутствие используемого в диагностикуме фермента или субстрата (свободного или связанного) в биологических или клинических образцах, которые предстоит анализировать. В-третьих, наличие соответствующей регистрирующей аппаратуры (спектрофотометра или спектрофлуориметра). И, наконец, в-четвертых, выбор той или иной фермент-субстратной пары диктуется естественным желанием экспериментатора или клинициста иметь в руках систему, обладающую максимальной специфичностью и чувствительностью.
Таблица: Фермент-субстратные системы, наиболее часто используемые в твердофазном ИФА
|
Фермент |
Субстрат |
Способ |
Длина волны наблюдения (н/м) |
Чуствительность нг/образец |
|
Щелочная фосфатаза |
Паранитрофенилфосфат 4-метилумбеллиферил-фосфат Н-аденозинмонофосфат |
Фотометрия Флуорометрия Радиометрия |
400,405 450(360) - |
0,5-20 10-4-10-2 10-2 |
|
Пероксидаза |
аминосалициловая кислота Ортотолуидин(ОТ) 0ртофенилендиамин(ОФД) Ортодианизидин (ОД) Парагидроксифенилпропио - новая кислота |
Фотометрия -//- -//- -//- Флуорометрия |
450,474,520 630 450,492 400 405(320) |
100 - 2,5 20 5*105 |
|
b -галактозидаза |
Ортонитрофенил-b-D-галактозид 4-метилумбеллиферил-b-D-галактозид Флуоресцеин-ди (b-галактозид) |
Фотометрия Флуорометрия Флуорометрия |
410,420 450(360) 450(360) |
0,01-10 10-6—10-2 2*10-2 |
Реферат опубликован: 23/05/2005 (11809 прочтено)