Страница: 6/7
Подготовка проб Для приготовления анализируемого образца для ЭФ брали 1 мг лиофилизированных мембран эритроцитов и растворяли в 40 мкл уравновешивающего буфера, в состав которого входили:
(на 10 мл уравновешивающего буфера)
3 г мочевины;
0,2 г ДДС;
1,25 мл раствора 3;
0,5 мл меркаптоэтанола;
5 мкл красителя бромфенолового синего.
Уравновешивающий буфер хранили при температуре -20°С в течение месяца.
Подготовленные таким образом анализируемые образцы стояли в течение одного часа при комнатной температуре, после чего их вносили объемом 15 мкл в сформированные в концентрирующем геле лунки.
Электрофорез проводили при силе тока 35 мА, пока напряжение не возрастало до 300 В, затем стабилизировали источник питания по данному напряжению и проводили ЭФ этом режиме, пока лидирующий краситель не доходил 1 см до края пластины.
После ЭФ фореграммы окрашивали в течение одного часа красителем Кумасси G - 255 по модифицированной методике Fairbanks в растворе, содержащем 10% уксусной кислоты, 25% изопропанола, 0,05% кумасси голубого. После этого несвязавшуюся краску отмывали в течение 12 часов 10%-ной уксусной кислотой до полного исчезновения фонового окрашивания.
Отмытые фореграммы затем дегидратировали в течение 30 минут в растворе, содержащем 280 мл изопропанола, 25 мл глицерина и 195 мл дистиллированной воды. Далее пластины ПААГ плотно фиксировали между двумя слоями целлюлозной бумаги и в натянутом виде высушивали при комнатной температуре.
На электрофореграммах идентифицировали 17 белковых фракций.
Денситометрирование. Денситометрирование электрофореграмм проводили на лазерном денситометре «Ultrascan XL». Молекулярную массу белков определяли с помощью маркерных белков с известной молекулярной массой: бычий сывороточный альбумин (Mr=68 kD), овальбумин (Mr=43 kD), химотрипсиноген (Мr=25 kD), миоглобин (Мr=17,5 kD) и цитохром (Мr=12,4 kD).
Определение концентрации белка. Содержание белковых фракций в исследуемом образце определяли по известной массе маркерного белка бычьего сывороточного альбумина, через полученные при деситометрировании площади альбумина и каждой белковой фракции в отдельности по формуле:
m(x)=S(x)´4.5/S(a),
где m(x) – масса белковой фракции,
S(x) – площадь этой фракции под пиком на денситограмме
4.5 – масса маркерного белка альбумина в мкг,
S(a) – площадь маркерного белка альбумина под пиком на денситограмме.
Дальнейший пересчет количественного содержания белковых фракций проводили на 1 миллиграмм общего белка.
Методы статистической обработки
Статистическая обработка материала проведена на ПВМ IBM PC/AT (486) с использованием программы "Gen 1", составленной д.б.н Трубниковым В.И. и пакета прикладных программ "STATGRAPHICS v3.0".
При описании количественных признаков использовались параметры нормального распределения: среднее значение, стандартная ошибка среднего значения, несмещенная дисперсия. Для проверки статистических гипотез использовались параметрические критерии Стьюдента и Фишера. Уровень значимости принимали равный 0,05.
Кластерный анализ. При проведении кластерного анализа в качестве объектов выступали индивиды и изучаемые признаки, а мерой сходства служили коэффициенты корреляции без учета знака. Результаты кластерного анализа позволили определить соответственно некоррелированные группы изучаемых параметров, детерминирующих фенотипическую изменчивость признаков. На каждом шаге кластеризации выбирался наибольший по значению элемент матрицы, стоящий на пересечении i-й строки и j-го столбца объединения i-го и j-го признаков в кластер, рассматриваемый как новый признак. Для выделения кластера пересчитывались значения коэффициентов корреляции в матрице с тем, чтобы на следующем шаге кластеризации поиск максимального коэффициента корреляции проводился с учетом предыдущих результатов. Приведенный алгоритм кластерного анализа служил лишь для подразделения корреляционной матрицы на отдельные подсистемы без проверки статистической значимости уровней объединения кластеров. Проверка гипотезы о некоррелированности выделенных подсистем осуществлялась с использованием специальных критериев.
РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ
Количественное содержание гемоглобина и основных белков мембран эритроцитов человека.
В ходе данной работы нами было проведено изучение количественного содержания основных белков эритроцитарных мембран и мембрансвязанного гемоглобина. Полученные результаты представлены в таблице 1.
В зависимости от электрофоретической подвижности белки были разделены на 15 фракций, 16-ю составил гемоглобин. При электрофорезе белковые фракции расположились по мере уменьшения молекулярных масс белков. Из таблицы 1 видно, что наиболее представительными белками в мембранах эритроцитов человека являются анионтранспортный белок полосы 3, a- и b-спектрины и актин. Второе место по количественному содержанию заняли белки полосы 4.5 (транспортер глюкозы и нуклеозидов), белки полосы 7 (основным белком этой полосы является тропомиозин) и белок полосы 4.2 (паллидин).
Менее представительными оказались анкирины 2.1, 2.2, и 2.3, белок полосы 4.1, глицеральдегид-3-фосфатдегидрогеназа и глутатион-S-трансфераза. Наименьшим содержанием отличался белок полосы 4.9 и мембрансвязанный гемоглобин. Количественное содержание гемоглобина составило 17,40±0,74 мкг на 1 мг общего белка мембран. Кроме того, гемоглобину соответствовало и наименьшее значение дисперсии (d2= 66,91).
Проведенное исследование количественного содержания основных белков мембран эритроцитов позволило оценить их представительность. Полученные нами показатели согласуются с литературными данными. [4, 5]
Взаимное варьирование количественной представительности отдельных белков эритроцитов человека.
С целью установления особенностей взаимного варьирования содержания белковых фракций в анализируемых образцах нами был проведен многомерный количественного содержания белков эритроцитарных мембран человека. Была построена матрица фенотипических корреляций количественного содержания гемоглобина и основных белков мембран эритроцитов. Данная матрица представлена в таблице 2. Из нее видно, что полученные коэффициенты корреляции имели как положительную, так и отрицательную направленность.
Для установления приоритетности во взаимосвязях вариабельности количественного содержания гемоглобина и основных мембранных белков эритроцитов нами был проведен кластерный анализ. Полученные результаты представлены на рисунке 6.
Кластерный анализ корреляционной матрицы позволил выделить 4 группы взаимнокоррелирующих белков по их количественному содержанию. Первую группу составили a- и b-спектрины, белки полосы 4.1, 4.2 (r=0,255). В состав второй группы вошли анкирины 2.1, 2.2 и 2.3 (r=0,278). Третью группу образовали гемоглобин, тропомиозин, глютатион-S-трансфераза и белок полосы 4.5.1 (r=0,316). Четвертую группу составили актин, белки полосы 4.5, глицеральдегид-3-фосфатдегидрогеназа и анионтранспортный белок полосы 3 (r=0,209). Исключение составила фракция 4.9, вариабельность количественного содержания которой носила независимый характер.
Низкий уровень объединения наблюдался между количественным содержанием анкирином 2.3 и анкирином 2.1 и 2.2 (r=0,278), актином и белком полосы 4.5 (r=0,327).
Рисунок 6
Дендрограмма фенотипических корреляций количественного содержания гемоглобина и основных белков мембран эритроцитов человека
N = 124 R (5%) = 0,176
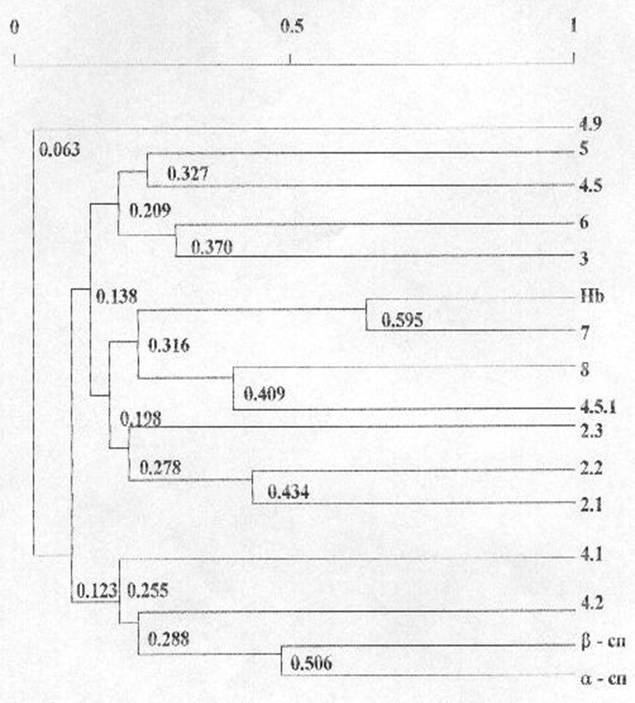
Группу кластеров со средним уровнем объединения составили анкирины 2.1 и 2.2
(r=0,434), глутатион-S-трансфераза и белок полосы 4.5.1 (r=0,409), глицеральдегид-3-фосфатдегидрогеназа
и белок полосы 3 (r=0,370).
Высокий уровень объединения имел место между количественным содержанием a- и b-спектринов (r=0,506)
Самый высокий уровень объединения (r=0,595) соответствовал количественному содержанию гемоглобина и белков полосы 7, основным составляющим белком которой является тропомиозин.
Обсуждение
На основе полученных данных установлено, что наиболее представительными белками в мембранах эритроцитов человека являются анионтранспортный белок полосы 3, a- и b-спектрины, а также актин. Наименьшее количественное содержание соответствует мембрансвязанному гемоглобину. Несмотря на то, что он содержится в мембране эритроцитов человека в меньшем количестве, гемоглобин играет важную роль как в образовании и поддержании стабильности цитоскелета, так и в механизмах ферментативного катализа и внутриклеточной трансформации энергии.
Полученные данные позволили предположить, что в эритроцитарных мембранах рассматриваемые белки во взаимном варьировании их количественного содержания образуют 4 группы взаимнокоррелирующих систем. Причем каждая из этих групп по отношению к остальным характеризуется относительной независимостью.
Согласно результатам нашего исследования количественное содержание гемоглобина наиболее тесно связано с содержанием тропомиозина. О причинах этого пока судить трудно вследствие недостаточного количества данных, касающихся этого вопроса - в доступной нам литературе он не получил должного освещения. Но мы надеемся, что полученные данные послужат основой для дальнейшей детализации в изучении связи гемоглобина со структурными белками.
Реферат опубликован: 8/04/2005 (16802 прочтено)